रासायनिक प्रतिक्रियाएँ और समीकरण | General Awareness & Knowledge for RRB NTPC (Hindi) - RRB NTPC/ASM/CA/TA PDF Download
भौतिक और रासायनिक परिवर्तन

- भौतिक परिवर्तन: ऐसे परिवर्तन जो केवल भौतिक गुणों जैसे रंग, घनत्व, कठोरता, पिघलने का बिंदु आदि को प्रभावित करते हैं, बिना पदार्थ की रासायनिक संरचना को बदले। ये परिवर्तन तापमान और दबाव को समायोजित करके उलटे जा सकते हैं। उदाहरणों में क्रिस्टलीकरण, सब्लिमेशन, उबालना, वाष्पीकरण, पेड़ काटना, पानी में नमक घोलना, मोम जलाना, और बर्फ पिघलना शामिल हैं।
- रासायनिक परिवर्तन: ऐसे परिवर्तन जो पदार्थ की संरचना और रासायनिक गुणों को बदलते हैं, जिसके परिणामस्वरूप एक नई सामग्री का निर्माण होता है। रासायनिक परिवर्तन आमतौर पर तापमान और दबाव बदलने से उलटे नहीं जा सकते। उदाहरणों में मोमबत्ती जलाना (गैसों का उत्पादन), प्रकाश संश्लेषण, फलों का पकना, पानी का इलेक्ट्रोलिसिस, पाचन, कागज जलाना, और दूध का खट्टा होना शामिल हैं।
रासायनिक प्रतिक्रियाएँ
- एक रासायनिक प्रतिक्रिया एक रासायनिक परिवर्तन है जिसमें पदार्थ प्रतिक्रिया करते हैं और नई सामग्री उत्पन्न करते हैं।
- हमारे दैनिक जीवन में, हमें विभिन्न प्रकार की रासायनिक प्रतिक्रियाएँ देखने को मिलती हैं। उदाहरण: यदि दूध को गर्मियों में कुछ घंटों के लिए कमरे के तापमान पर रखा जाए, तो यह खट्टा हो जाता है और गाढ़ी दही के रूप में बदल जाता है।
- जब लोहे के सामानों को नम वातावरण में रखा जाता है, तो वे जंग लग जाते हैं।
- सेब का ताजा काटा हुआ टुकड़ा कुछ समय बाद भूरे रंग में बदल जाता है। भोजन का पकना और पचाना भी रासायनिक प्रतिक्रियाओं में शामिल होता है।
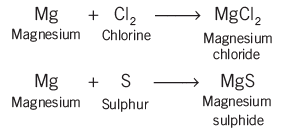
- मैग्नीशियम का रिबन चमकीली सफेद लौ के साथ जलता है और सफेद पाउडर में बदल जाता है। यह पाउडर मैग्नीशियम ऑक्साइड है। यह एक रासायनिक प्रतिक्रिया का उदाहरण है।
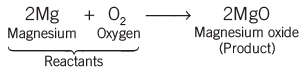
- एक रासायनिक प्रतिक्रिया की पहचान निम्नलिखित अवलोकनों की मदद से की जा सकती है:
- स्थिति में परिवर्तन
- रंग में परिवर्तन
- गैस का उत्सर्जन
- तापमान में परिवर्तन
- एक रासायनिक प्रतिक्रिया में किसी भी दो परमाणुओं के बीच बंधन का टूटना या बंधन का निर्माण शामिल होता है, जिससे नई सामग्री का उत्पादन होता है।
रासायनिक प्रतिक्रियाओं के प्रकार
संयोग प्रतिक्रियाएँ:
- एक बीकर में थोड़ी मात्रा में कैल्शियम ऑक्साइड लें और उसमें पानी डालें।
- कैल्शियम ऑक्साइड पानी के साथ जोरदार प्रतिक्रिया करता है और एक बड़ा मात्रा में ऊर्जा रिलीज करते हुए चूना पत्थर (slaked lime) बनाता है।
- यह एक संयोग प्रतिक्रिया का उदाहरण है।
- संयोग प्रतिक्रिया में, दो या दो से अधिक पदार्थ मिलकर एक एकल उत्पाद बनाते हैं।
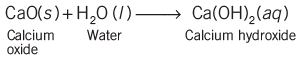
विघटन प्रतिक्रियाएँ:
एक विघटन प्रतिक्रिया में, एकल यौगिक दो या दो से अधिक सरल पदार्थों में टूट जाता है।
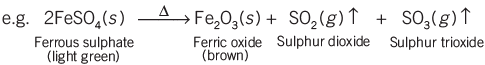
इन प्रतिक्रियाओं के लिए गर्मी, प्रकाश या बिजली के रूप में ऊर्जा की आवश्यकता होती है। इसलिए, विघटन प्रतिक्रियाएँ तीन प्रकारों में आती हैं: थर्मल विघटन, प्रकाश विघटन, और इलेक्ट्रोलिसिस।
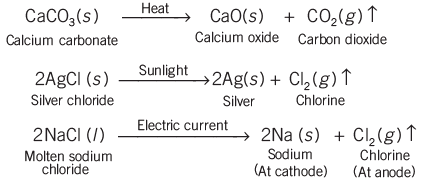
प्रत्येक का उदाहरण नीचे दिया गया है:
- थर्मल विघटन: यौगिक को तोड़ने के लिए गर्मी का उपयोग किया जाता है।
- प्रकाश विघटन (photolysis): विघटन के लिए प्रकाश ऊर्जा का उपयोग किया जाता है।
- इलेक्ट्रोलिसिस: यौगिक को विघटित करने के लिए बिजली का उपयोग किया जाता है।
डिसोसिएशन प्रतिक्रियाएँ:
ये पुनरावृत्त प्रतिक्रियाएँ हैं जहाँ एक अणु गर्मी या प्रकाश द्वारा सरल अणुओं में टूट जाता है।

डिस्प्लेसमेंट प्रतिक्रियाएँ:
- जब एक लोहे की कील को कॉपर सल्फेट समाधान में रखा जाता है, तो यह भूरे रंग की हो जाती है और समाधान का नीला रंग फीका पड़ जाता है। यह दिखाता है कि लोहे ने समाधान में कॉपर को प्रतिस्थापित कर दिया है, जो कि एक प्रकार की डिस्प्लेसमेंट प्रतिक्रिया है।
- डिस्प्लेसमेंट प्रतिक्रियाओं में अक्सर रंग में बदलाव होता है, जहाँ एक अधिक प्रतिक्रियाशील पदार्थ कम प्रतिक्रियाशील पदार्थ की जगह लेता है।
- जब सोडियम सल्फेट को बेरियम क्लोराइड के साथ मिलाया जाता है, तो एक सफेद पदार्थ बनता है जो पानी में घुलता नहीं है। इस पदार्थ को अवशिष्ट कहा जाता है, और प्रतिक्रिया को अवशिष्ट प्रतिक्रिया कहा जाता है, जो कि एक प्रकार की डबल डिस्प्लेसमेंट प्रतिक्रिया है।
- डिस्प्लेसमेंट प्रतिक्रियाओं में, रासायनिक पदार्थों के बीच आयन का आदान-प्रदान होता है ताकि नए यौगिक बन सकें।
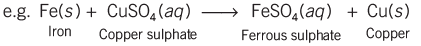
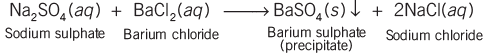
उष्माक्षेपी और अंतःक्षेपी प्रतिक्रियाएँ:
उष्माक्षेपी प्रतिक्रियाएँ: उत्पाद निर्माण के साथ गर्मी जारी होती है। उदाहरण: ईंधन जलाना।
- अंतर्दृष्य प्रतिक्रियाएँ: प्रतिक्रिया के दौरान गर्मी अवशोषित होती है।
प्रतिवर्ती और अपरिवर्ती प्रतिक्रियाएँ:
- प्रतिवर्ती प्रतिक्रियाएँ: ये आगे और पीछे दोनों दिशाओं में होती हैं लेकिन कभी पूर्णता तक नहीं पहुँचतीं।
- अपरिवर्ती प्रतिक्रियाएँ: ये केवल आगे की दिशा में होती हैं और पूर्णता तक पहुँचती हैं।
रेडॉक्स प्रतिक्रियाएँ:
इनमें ऑक्सीकरण और अपकर्षण शामिल होते हैं, जो दो अर्ध-प्रतिक्रियाएँ हैं। उदाहरणों में ईंधन का दहन, सोडियम हाइड्रॉक्साइड का उत्पादन, प्रकाश संश्लेषण, भोजन का पाचन, बैटरी की क्रियाएँ और धातु का जंग लगना शामिल हैं। ये प्रतिक्रियाएँ ऑक्सीकरण और अपकर्षण दोनों प्रक्रियाओं को शामिल करती हैं।
ऑक्सीकरण और अपकर्षण:
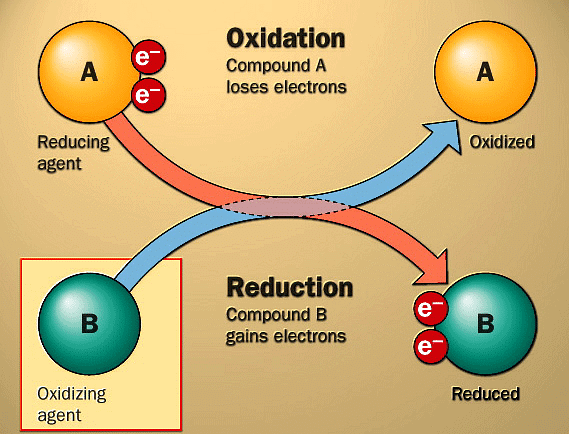
- शुरुआत में, जब किसी पदार्थ में ऑक्सीजन जोड़ा जाता था, तो इसे ऑक्सीकरण कहा जाता था। बाद में, किसी पदार्थ से हाइड्रोजन निकालना भी ऑक्सीकरण के रूप में देखा गया। ऑक्सीकरण में इलेक्ट्रॉनों की भूमिका महत्वपूर्ण होती है। उदाहरण के लिए, मैग्नीशियम मैग्नीशियम 2 आयन में बदलता है और दो इलेक्ट्रॉनों को खोता है, जो दिखाता है कि ऑक्सीकरण में इलेक्ट्रॉनों का ह्रास होता है।
- अपकर्षण की परिकल्पना पहली बार धातु ऑक्साइड को धातुओं में बदलने के लिए हाइड्रोजन, कार्बन या कार्बन मोनोक्साइड का उपयोग करने वाले प्रक्रियाओं के लिए की गई थी। किसी पदार्थ से ऑक्सीजन को निकालना अपकर्षण माना जाता था।
- अपकर्षण प्रतिक्रियाओं में, जैसे जब कॉपर 2 कॉपर में बदलता है और दो इलेक्ट्रॉनों को प्राप्त करता है, इलेक्ट्रॉनों का अधिग्रहण होता है।
- ऑक्सीकरण और अपकर्षण एक रेडॉक्स प्रतिक्रिया में समानांतर और समान रूप से होते हैं।
ऑक्सीकरण एजेंट (Oxidant): यह एक पदार्थ है जो रासायनिक प्रतिक्रिया में इलेक्ट्रॉनों को प्राप्त करता है, अर्थात् इलेक्ट्रॉन स्वीकारक ऑक्सीकरण एजेंट होते हैं। सभी सकारात्मक चार्ज वाले प्रजातियाँ ऑक्सीकरण एजेंट के रूप में कार्य करती हैं, जो कि लुईस अम्ल भी होते हैं।
अपकर्षण एजेंट (Reductant): रासायनिक प्रतिक्रिया में इलेक्ट्रॉनों को देने वाले पदार्थ को अपकर्षण एजेंट कहा जाता है, इसलिए इलेक्ट्रॉन दाता अपकर्षण एजेंट होते हैं। सभी नकारात्मक चार्ज वाले प्रजातियाँ अपकर्षण एजेंट होती हैं, जो कि लुईस आधार भी होती हैं।
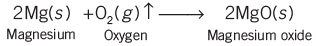
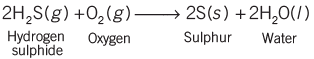
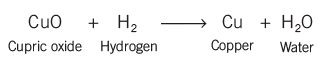
ऑक्सीकरण अवस्थाओं का निर्धारण करने के नियम:
एक तत्व की मुक्त या अव्यवस्थित स्थिति में ऑक्सीडेशन स्थिति शून्य होती है।
- हाइड्रोजन की ऑक्सीडेशन स्थिति सामान्यतः 1 होती है, लेकिन यह हाइड्राइड्स में -1 होती है।
- ऑक्सीजन की ऑक्सीडेशन स्थिति सामान्यतः -2 होती है, लेकिन यह पेरोक्साइड्स में -1 होती है।
- परियोजना तालिका के समूह IA, IIA, और IIIA में तत्वों की ऑक्सीडेशन स्थिति क्रमशः 1, 2, और 3 होती है।
- किसी भी आयन की ऑक्सीडेशन स्थिति उसके चार्ज के बराबर होती है।
- एक तटस्थ अणु में सभी तत्वों की ऑक्सीडेशन स्थितियों का बीजगणितीय योग शून्य होता है।
- एक बहु परमाणु आयन में सभी तत्वों की ऑक्सीडेशन स्थितियों का बीजगणितीय योग आयन के चार्ज के बराबर होता है।
- हैलाइड्स (हैलोज़ के साथ द्विआधारी यौगिकों) में हैलोज़ की ऑक्सीडेशन स्थिति -1 होती है।
- ऑक्सीजन OF2 में सकारात्मक ऑक्सीडेशन स्थिति प्रदर्शित करता है।
|
464 docs|420 tests
|




















