तत्वों की आवधिक वर्गीकरण | General Awareness & Knowledge for RRB NTPC (Hindi) - RRB NTPC/ASM/CA/TA PDF Download
आवर्त सारणी का विकास

- कई तत्वों और उनके यौगिकों की खोज के साथ, इनका अध्ययन व्यक्तिगत रूप से करना कठिन हो गया।
- तत्वों को समूहों में वर्गीकृत करना आवश्यक था ताकि अध्ययन अधिक व्यवस्थित और आसान हो सके।
- इस दिशा में कई प्रयास किए गए, जिनमें प्राउट का एकात्मक सिद्धांत, डोबेरेनर का त्रैतीय नियम, न्यूलैंड का ऑक्टेव का नियम, और लोथर मेयर का वक्र शामिल हैं।
- हालांकि, इन तरीकों ने सभी ज्ञात तत्वों को व्यवस्थित करने में असफलता हासिल की।
- इस दिशा में पहला महत्वपूर्ण प्रयास मेंडेलीव द्वारा किया गया, जिन्होंने तत्वों को बढ़ती हुई परमाणु द्रव्यमान के अनुसार व्यवस्थित किया।
मेंडेलीव की आवर्त सारणी (1869)
मेंडेलीव की आवर्त सारणी उनके आवर्त नियम पर आधारित थी, जिसमें कहा गया था कि "तत्वों की भौतिक और रासायनिक विशेषताएँ उनके परमाणु द्रव्यमान का आवर्त कार्य हैं।" उनकी सारणी में सात अवधि और आठ समूह थे, लेकिन 0 समूह (अक्रिय गैसें) अनुपस्थित था। मेंडेलीव ने उन तत्वों के लिए जगह छोड़ी जो उस समय ज्ञात नहीं थे, जैसे एका-बोरोन, एका-एल्यूमिनियम, और एका-सिलिकॉन, जो बाद में क्रमशः स्कैंडियम, गैलियम, और जर्मेनियम के रूप में खोजे गए। सारणी में हाइड्रोजन के लिए एक निश्चित स्थान नहीं था, आइसोटोप के लिए कोई स्थान नहीं था, और परमाणु द्रव्यमान को नियमित रूप से व्यवस्थित नहीं किया गया था, जिसके कारण इसकी संशोधन की आवश्यकता थी।
आधुनिक आवर्त नियम
1913 में, मोस्ले ने मेंडेलीव के आवर्त नियम में संशोधन किया और आधुनिक आवर्त नियम का प्रस्ताव रखा, जिसमें कहा गया कि "तत्वों की भौतिक और रासायनिक विशेषताएँ उनके परमाणु संख्या का आवर्त कार्य हैं।" मोस्ले ने यह पाया कि परमाणु संख्या परमाणु द्रव्यमान से अधिक मौलिक विशेषता है।
दीर्घकालिक आवर्त सारणी
- दीर्घकालिक आवर्त सारणी, जिसे बोहर की सारणी भी कहा जाता है, बोहर-बुरी के इलेक्ट्रॉनिक कॉन्फ़िगरेशन के सिद्धांत पर आधारित है।
- इसमें सात पीरियड (क्षैतिज पंक्तियाँ) और अठारह समूह (ऊर्ध्वाधर स्तंभ) होते हैं।
- पीरियड संख्या एक तत्व के बाहरी शेल की संख्या के अनुसार होती है।
- प्रत्येक पीरियड का पहला तत्व (पहले पीरियड को छोड़कर) एक क्षारीय धातु होता है, और अंतिम तत्व एक अंतर्मुखी गैस होता है।
- लैंथेनॉइड और एक्टिनॉइड, जो छठे और सातवें पीरियड से संबंधित हैं, सारणी के नीचे दो अलग-अलग पंक्तियों में रखे जाते हैं।
- एक समूह के सभी सदस्य समान बाहरी शेल इलेक्ट्रॉनिक कॉन्फ़िगरेशन रखते हैं।
- समूह 1, 2, 13, 14, 15, 16, 17, और 18 को सामान्य या प्रतिनिधि तत्वों के रूप में जाना जाता है, जबकि समूह 3 से 12 को संक्रमण तत्व कहा जाता है।
- यह सारणी तत्वों के इलेक्ट्रॉनिक कॉन्फ़िगरेशन पर आधारित है और इसमें 118 तत्व शामिल हैं, जो ऑफबॉउ सिद्धांत का पालन करती है।
- ऐसे तत्व जिनके परमाणु संख्या 3, 11, 19, 37, 55, और 87 हैं, समान गुणों के साथ होते हैं और वे एक ही समूह में आते हैं।
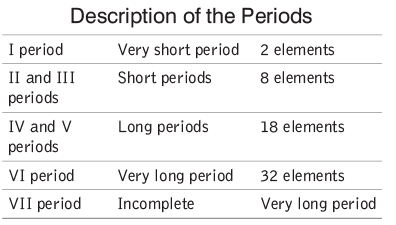
पीरियड्स की विशेषताएँ:
- एक पीरियड में बाएँ से दाएँ जाते समय तत्वों में वैलेन्स इलेक्ट्रॉनों की संख्या 1 से 8 तक बढ़ती है।
- एक पीरियड में तत्वों के परमाणु संख्या लगातार होती हैं।
- हाइड्रोजन के सापेक्ष, तत्वों की वैलेंसी बाएँ से दाएँ जाते समय 1 से 4 तक बढ़ती है और फिर 0 तक घटती है।
समूहों की विशेषताएँ:
- एक समूह में सभी तत्वों में समान वैलेन्स इलेक्ट्रॉनों की संख्या होती है, जिससे समान रासायनिक गुण उत्पन्न होते हैं।
ब्लॉक तत्व: तत्वों को चार ब्लॉकों में वर्गीकृत किया जा सकता है:
- s-Block तत्व: समूह 1 और 2, जिसमें हाइड्रोजन, क्षारीय धातुएं (Li, Na, K, Rb, Cs, Fr), और क्षारीय पृथ्वी धातुएं (Be, Mg, Ca, Sr, Ba, Ra) शामिल हैं, जिनका सामान्य संरचना ns1 − 2 है। ये तत्व नरम धातुएं हैं, इलेक्ट्रो-पॉजिटिव हैं, और बेसिक ऑक्साइड बनाते हैं।
- p-Block तत्व: समूह 13 से 18, जिनका सामान्य संरचना ns2np1 − 6 है। इस ब्लॉक में धातुएं, अधातुएं, और धातु-रहित तत्व शामिल हैं। भारी तत्वों में इनर्ट पेयर प्रभाव दिखाई देता है, जिससे उनकी निम्न वैलेंस अधिक स्थिर होती है।
- d-Block तत्व: समूह 3 से 12, जिनका सामान्य संरचना (n − 1)d1 − 10ns1 − 2 है। ये संक्रमण तत्व हैं (समूह 12 को छोड़कर), जिनमें अविवाहित इलेक्ट्रॉन्स होते हैं और बाहरी तथा पिछले शेल के बीच की छोटी ऊर्जा के कारण परिवर्तनशील वैलेंसी दिखाई देती है। ये तत्व आमतौर पर रंगीन होते हैं और कैटलिस्ट के रूप में उपयोग किए जाते हैं।
- f-Block तत्व: मुख्य आवर्त सारणी के नीचे स्थित, जिसमें लैंथेनाइड और ऐक्टिनाइड शामिल हैं, जिनका सामान्य संरचना (n − 2)f1−14(n − 1)d0 − 1ns2 है। ये आंतरिक-परिवर्तन तत्व समूह IIIB (3) के अंतर्गत आते हैं।
जर्मनी के डार्मस्टाट में GSI हेल्महोल्ट्ज केंद्र के शोधकर्ताओं ने तत्व 117, जिसे अस्थायी रूप से अनुनसेप्टियम कहा जाता है, के कई परमाणुओं का निर्माण और अवलोकन किया है। आवर्त सारणी में, अनुनसेप्टियम समूह 17 में स्थित है। जबकि पिछले समूह 17 के सदस्य हैलोंजेन हैं, अनुनसेप्टियम की गुणधर्म काफी भिन्न होने की संभावना है, हालाँकि प्रमुख गुण जैसे पिघलने का बिंदु, उबालने का बिंदु, और आयननकरण संभावना आवर्तीय प्रवृत्तियों का पालन करने की अपेक्षा की जाती है।
अवधिक गुण
अवधिक गुण वे विशेषताएँ हैं जो आवर्त सारणी में नियमित अंतराल पर दोहराई जाती हैं, जो समूहों और अवधियों के साथ एक सुसंगत पैटर्न प्रदर्शित करती हैं। कुछ महत्वपूर्ण अवधिक गुण निम्नलिखित हैं:

- आयनन उत्सर्जन ऊष्मा (Ionisation Enthalpy): एक तत्व के एकाकी गैसीय परमाणु से एक इलेक्ट्रॉन को हटाने के लिए आवश्यक न्यूनतम ऊर्जा, जिससे एक सकारात्मक आयन बनता है। आयनन उत्सर्जन ऊष्मा एक अवधिका के साथ बढ़ती है, लेकिन समूह के नीचे घटती है। बोरॉन और ऑक्सीजन के पास बेरिलियम और नाइट्रोजन की तुलना में कम आयनन ऊर्जा होती है, जो उनके स्थिर इलेक्ट्रॉनिक संरचनाओं के कारण है।
- इलेक्ट्रॉन अधिग्रहण ऊष्मा (Electron Gain Enthalpy): एक अतिरिक्त इलेक्ट्रॉन को एक तटस्थ गैसीय परमाणु में जोड़ने पर मुक्त होने वाली ऊर्जा। इलेक्ट्रॉन अधिग्रहण ऊष्मा एक अवधिका के साथ बढ़ती है और समूह के नीचे घटती है, कुछ अपवादों के साथ।
- इलेक्ट्रोनगेटिविटी (Electronegativity): एक परमाणु की साझा इलेक्ट्रॉनों के जोड़े को अपनी ओर आकर्षित करने की क्षमता। इलेक्ट्रोनगेटिविटी एक अवधिका के साथ बढ़ती है और समूह के नीचे घटती है।
- धात्विक चरित्र (Metallic Character): एक तत्व का कैशन बनाने के लिए इलेक्ट्रॉनों को खोने की प्रवृत्ति। धात्विक चरित्र एक अवधिका के साथ घटता है और समूह के नीचे बढ़ता है।
- ऑक्सीडाइजिंग और रिड्यूसिंग चरित्र (Oxidising and Reducing Character): रिड्यूसिंग चरित्र एक अवधिका के साथ घटता है और समूह के नीचे बढ़ता है, जबकि ऑक्सीडाइजिंग चरित्र एक अवधिका के साथ बढ़ता है और समूह के नीचे घटता है।
- वालेंसी (Valency): हाइड्रोजन के संदर्भ में, वालेंसी एक अवधिका के साथ 1 से 7 तक बढ़ती है। ऑक्सीजन के संदर्भ में, यह पहले 1 से 4 तक बढ़ती है और फिर 1 तक घटती है (OF2 को छोड़कर)। वालेंसी एक समूह में समान रहती है।
- ऑक्साइड का मूल गुण (Basic Nature of Oxides): ऑक्साइड का मूल गुण एक अवधिका के साथ घटता है जबकि अम्लीय गुण बढ़ता है। इसके विपरीत, एक समूह के नीचे, ऑक्साइड का मूल गुण बढ़ता है जबकि अम्लीय गुण घटता है।
हाइड्रोजन (Hydrogen)
हाइड्रोजन एक गैर-धातु है जो अत्यधिक दबाव के तहत धात्विक रूप ले लेता है। यह जीवित जीवों के वजन का लगभग 10% बनाता है और यह ब्रह्मांड में सबसे प्रचुर तत्व है, जो ब्रह्मांड के कुल द्रव्यमान का 70% बनाता है। इसके संयोजित रूप में, हाइड्रोजन पृथ्वी की परत में तीसरा सबसे प्रचुर तत्व है। यह सूरज और तारों का एक मौलिक घटक है।
हाइड्रोजन के विभिन्न रूप
- नवजात हाइड्रोजन: यह हाइड्रोजन का रूप रासायनिक प्रतिक्रिया के दौरान अचानक प्रकट होता है और यह आण्विक हाइड्रोजन की तुलना में अधिक प्रतिक्रियाशील होता है।
- आणविक हाइड्रोजन: यह आण्विक हाइड्रोजन के विघटन द्वारा उत्पन्न होता है।
- ऑर्थो हाइड्रोजन: इस रूप में, हाइड्रोजन परमाणुओं के नाभिक एक ही दिशा में घूमते हैं।
- पैरा हाइड्रोजन: इस रूप में, हाइड्रोजन परमाणुओं के नाभिक विपरीत दिशाओं में घूमते हैं।
हाइड्रोजन के समस्थानिक
- प्रोटियम (1H1): इस समस्थानिक का परमाणु संख्या और द्रव्यमान संख्या 1 है।
- ड्यूटेरियम (1H2): इसे भारी हाइड्रोजन के रूप में जाना जाता है, इसकी परमाणु संख्या 1 और द्रव्यमान संख्या 2 है। इसे 1931 में उरे, ब्रिकवेड और मर्फी द्वारा खोजा गया था। यह जैविक प्रतिक्रिया तंत्रों को स्पष्ट करने और परमाणु प्रतिक्रियाओं में बमबारी कणों के रूप में उपयोग किया जाता है।
- ट्रिटियम (1H3): यह एक दुर्लभ और रेडियोधर्मी समस्थानिक है, जिसकी परमाणु संख्या 1 और द्रव्यमान संख्या 3 है। यह एक बीटा उत्सर्जक है जिसकी आधी आयु 12.4 वर्ष है।
हाइड्रोजन के यौगिक
- पानी (H2O): पानी जीवित प्राणियों का लगभग 65% से 95% बनाता है और यह तीन भौतिक अवस्थाओं में मौजूद होता है: ठोस (बर्फ), तरल (पानी), और गैस (पानी का वाष्प)। यह एक रंगहीन, गतिशील, और वाष्पशील तरल है जिसमें पानी के अणुओं के बीच व्यापक हाइड्रोजन बंधन के कारण अनूठे गुण होते हैं। पीने का पानी उबालने, क्लोरीनीकरण, ओज़ोननिज़ेशन, या पराबैंगनी विकिरण के माध्यम से शुद्ध किया जाता है।
पानी के प्रकार:

- मुलायम पानी: साबुन के साथ झाग बनाता है।
- कठोर पानी: साबुन के साथ झाग नहीं बनाता है। कठोरता कैल्शियम या मैग्नीशियम बाइकार्बोनेट (अस्थायी कठोरता) या कैल्शियम या मैग्नीशियम के क्लोराइड या सल्फेट (स्थायी कठोरता) की उपस्थिति के कारण होती है।
कठोरता की डिग्री
कठोरता की डिग्री को 106 भाग पानी में मौजूद CaCO3 या इसके समकक्ष विभिन्न कैल्शियम या मैग्नीशियम लवण के भागों की संख्या के रूप में परिभाषित किया जाता है।
भारी पानी (D2O): 1932 में उरे और वाशबर्न द्वारा खोजा गया, भारी पानी साधारण पानी के 6000 भागों में एक भाग की अनुपात में मौजूद होता है। यह एक रंगहीन, गंधहीन, स्वादहीन तरल है जिसकी अधिकतम घनत्व 11.6°C पर 1.1073 g/mL है। भारी पानी के भौतिक गुण साधारण पानी की तुलना में अधिक होते हैं, क्योंकि इसमें ड्यूटेरियम का अधिक नाभिकीय द्रव्यमान और मजबूत हाइड्रोजन बंधन होता है। रासायनिक रूप से, यह साधारण पानी की तुलना में अधिक धीरे प्रतिक्रिया करता है, जो आइसोटोपिक प्रभाव के कारण है।
भारी पानी के प्रभाव:
- जैव रासायनिक प्रतिक्रियाएं काफी प्रभावित होती हैं।
- बीज भारी पानी में अंकुरित नहीं होते।
- किण्वन की दर कम हो जाती है।
- जैव-जीवों की वृद्धि रुक जाती है।
- तलाब के मेंढ़क और मछलियों जैसे जलीय जीव भारी पानी में मर जाते हैं।
हाइड्रोजन पेरोक्साइड (H2O2): थेनार्ड द्वारा खोजा गया, हाइड्रोजन पेरोक्साइड को ऑक्सीजनयुक्त पानी भी कहा जाता है और यह वातावरण, पौधों, वर्षा, और बर्फ मेंTrace मात्रा में पाया जाता है। यह प्रकाश में विघटित हो जाता है और इसके विघटन को रोकने के लिए इसे गहरे रंग की या मोम-लेपित बोतलों में संग्रहित किया जाता है।
हाइड्रोजन पेरोक्साइड (30% पेरहाइड्रोल) के उपयोग:
- घावों, कानों और दांतों के लिए कीटाणुनाशक और एंटीसेप्टिक के रूप में।
- दूध और प्रोटीन के लिए संरक्षक के रूप में।
- ऊन और अन्य नरम सामग्रियों के लिए ब्लीचिंग एजेंट के रूप में।
|
464 docs|420 tests
|















