आणविक संरचना | General Awareness & Knowledge for RRB NTPC (Hindi) - RRB NTPC/ASM/CA/TA PDF Download
अणु और परमाणु
परमाणु: एक तत्व (या पदार्थ) की सबसे छोटी इकाई जो रासायनिक प्रतिक्रिया में भाग लेती है। परमाणु इलेक्ट्रॉनों, प्रोटॉनों, और न्यूट्रॉनों से मिलकर बने होते हैं।

अणु: एक पदार्थ की सबसे छोटी इकाई जो रासायनिक प्रतिक्रिया में भाग नहीं लेती। अणु दो या अधिक परमाणुओं से बने होते हैं, जो समान या विभिन्न प्रकार के हो सकते हैं।
- होमोएटोमिक अणु: समान प्रकार के परमाणुओं से बने होते हैं (जैसे, O2, H2, N2)।
- हेटेरोएटोमिक अणु: विभिन्न प्रकार के परमाणुओं से बने होते हैं (जैसे, HCl, N2O, CO2)।
परमाणु के मौलिक और उपपरमाणु कण
- मौलिक कण: इलेक्ट्रॉन, प्रोटॉन, और न्यूट्रॉन।
- उपपरमाणु कण: मौलिक कणों के साथ-साथ मेसोन, पॉजिट्रॉन, और न्यूट्रिनो शामिल हैं।
- सभी तत्व, हाइड्रोजन को छोड़कर, ऐसे परमाणुओं में होते हैं जिनमें तीनों कण (प्रोटॉन, न्यूट्रॉन, इलेक्ट्रॉन) होते हैं, जिनमें ड्यूटेरियम और ट्रिटियम जैसे आइसोटोप शामिल हैं।

अतिरिक्त उपपरमाणु कण
- पॉजिट्रॉन: एंडरसन द्वारा 1932 में खोजा गया, इलेक्ट्रॉन का सकारात्मक चार्ज वाला समकक्ष।
- न्यूट्रिनो और एंटी-न्यूट्रिनो: फर्मी द्वारा 1934 में खोजा गया, छोटे द्रव्यमान और शून्य चार्ज वाले कण।
- मेसोन: इलेक्ट्रॉन और प्रोटॉन के बीच द्रव्यमान वाले कण, जो तटस्थ, सकारात्मक, और नकारात्मक चार्ज वाले रूपों में उपलब्ध हैं। सभी मेसोन अस्थिर होते हैं।
- बोसॉन: उपपरमाणु कण, जो मौलिक (जैसे कि फोटॉन) या संयोजक (जैसे मेसोन) हो सकते हैं।
- बेरियन: प्रोटॉन से भारी कण।
- क्वार्क: उपपरमाणु कण जो हैड्रॉन, जैसे प्रोटॉन और न्यूट्रॉन बनाने के लिए मिलते हैं। क्वार्क का एंटीपार्टिकल एंटी-क्वार्क होता है।
परमाणु से संबंधित कुछ महत्वपूर्ण शब्द
एक तत्व का परमाणु संख्या उसके परमाणु के नाभिक में उपस्थित प्रोटॉन की संख्या के बराबर होती है। एक पृथक परमाणु के लिए, परमाणु संख्या (Z) = प्रोटॉनों की संख्या = इलेक्ट्रॉनों की संख्या।
परमाणु वजन को सापेक्ष परमाणु द्रव्यमान भी कहा जाता है। द्रव्यमान संख्या न्यूक्लियनों (प्रोटॉनों और न्यूट्रॉनों) का योग है।
द्रव्यमान संख्या (A) = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या।
- एक अणु में उपस्थित कुल परमाणुओं की संख्या को परमाणुवादिता कहा जाता है। उदाहरण के लिए, नाइट्रोजन (N2) की परमाणुवादिता 2 है और अमोनिया (NH3) की 4 है।
- एक मोल पदार्थ में 6.023 × 1023 परमाणु या अणु होते हैं। इस संख्या को अवोगाद्रो संख्या कहा जाता है।
आइसोटोप, आइसोबार और आइसोटोन

- आइसोटोप: एक ही तत्व के ऐसे परमाणु जिनकी परमाणु संख्या समान होती है लेकिन द्रव्यमान संख्या अलग होती है (जैसे, कार्बन के लिए C-12 और C-14)।
- आइसोबार: विभिन्न तत्वों के ऐसे परमाणु जिनकी द्रव्यमान संख्या समान होती है लेकिन परमाणु संख्या अलग होती है।
- आइसोटोन: विभिन्न तत्वों के ऐसे परमाणु जिनमें न्यूट्रॉनों की संख्या समान होती है लेकिन परमाणु संख्या अलग होती है।
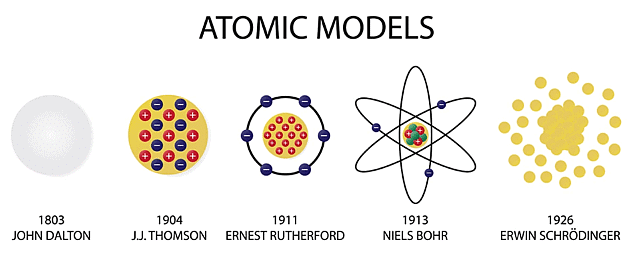
परमाणु मॉडल
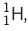
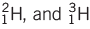
परमाणु में मौलिक कणों की व्यवस्था को दर्शाने के लिए कई परमाणु मॉडल प्रस्तावित किए गए हैं। कुछ महत्वपूर्ण मॉडल इस प्रकार हैं:
डाल्टन का परमाणु सिद्धांत
रासायनिक संयोजन के नियमों के आधार पर, डाल्टन के परमाणु सिद्धांत ने कई धारणाएँ प्रस्तुत कीं:
- सभी पदार्थ अद्वितीय और अटूट परमाणुओं से बने होते हैं।
- किसी दिए गए तत्व के सभी परमाणुओं की समान विशेषताएँ होती हैं, जिनमें समान द्रव्यमान भी शामिल है।
- परमाणु छोटे पूर्ण संख्याओं में संयोजित होकर यौगिक बनाते हैं।
- रासायनिक प्रतिक्रियाएँ केवल परमाणुओं का संयोजन, पृथक्करण या पुनर्व्यवस्था शामिल करती हैं।
थॉमसन का परमाणु मॉडल
- प्रत्येक परमाणु एक समान रूप से सकारात्मक चार्जित गोले से बना होता है, जिसकी त्रिज्या लगभग 10⁻¹⁰ मीटर होती है, जिसमें सम्पूर्ण द्रव्यमान समान रूप से वितरित होता है।
- नकारात्मक चार्जित इलेक्ट्रॉन्स इस गोले में यादृच्छिक रूप से समाहित होते हैं।
- कुल मिलाकर परमाणु तटस्थ होता है।
थॉमसन के परमाणु मॉडल की सीमाएँ:
- यह हाइड्रोजन और अन्य परमाणुओं की स्पेक्ट्रल श्रृंखला की उत्पत्ति को स्पष्ट नहीं कर सका।
- यह α-कणों के बड़े कोण के scattering को समझाने में असफल रहा।
रदरफोर्ड का परमाणु मॉडल
- परमाणु का सम्पूर्ण सकारात्मक चार्ज और लगभग सभी द्रव्यमान एक बहुत छोटे क्षेत्र में केंद्रित होता है, जिसे न्यूक्लियस कहा जाता है (आकार में लगभग 10⁻¹⁵ मीटर)।
- नकारात्मक चार्जित इलेक्ट्रॉन्स न्यूक्लियस के चारों ओर विभिन्न कक्षाओं में घूमते हैं।
- न्यूक्लियस पर कुल सकारात्मक चार्ज इलेक्ट्रॉन्स पर कुल नकारात्मक चार्ज के बराबर होता है, जिससे परमाणु कुल मिलाकर तटस्थ होता है।
- न्यूक्लियस के अस्तित्व को रदरफोर्ड के α-कण scattering प्रयोग द्वारा सिद्ध किया गया था।
- एक न्यूक्लियस में सकारात्मक चार्जित प्रोटॉन और विद्युत रूप से तटस्थ न्यूट्रॉन होते हैं। एक इलेक्ट्रॉन का चार्ज 1.67 × 10⁻¹⁹ होता है।
- न्यूक्लियस के चारों ओर इलेक्ट्रॉन के घूमने के लिए आवश्यक केंद्रीय बल इलेक्ट्रॉन्स और न्यूक्लियस के बीच के इलेक्ट्रोस्टैटिक आकर्षण बल द्वारा प्रदान किया जाता है।
रदरफोर्ड के परमाणु मॉडल की सीमाएँ:
- मैक्सवेल के विद्युत-चुंबकीय तरंग सिद्धांत के अनुसार, एक त्वरित चार्जित कण विद्युत-चुंबकीय तरंगों के रूप में ऊर्जा उत्सर्जित करता है। इसलिए, केंद्रीय त्वरितता के तहत अपनी कक्षीय गति में एक इलेक्ट्रॉन ऊर्जा उत्सर्जित करेगा, जिससे इसकी पथ की त्रिज्या धीरे-धीरे घटेगी, और अंततः, यह नाभिक में गिर जाएगा।
विद्युत-चुंबकीय विकिरण
- विद्युत-चुंबकीय विकिरण ऊर्जा है जो तरंगों के रूप में परिवहन की जाती है और यह विद्युत और चुम्बकीय क्षेत्रों दोनों से संबंधित होती है। विभिन्न प्रकार के विद्युत-चुंबकीय विकिरण मौजूद हैं, और एक निर्वात में, सभी प्रकार, चाहे उनका तरंगदैर्ध्य कुछ भी हो, समान गति (3.00 × 10⁸ m/s-1) से यात्रा करते हैं।
विभिन्न क्षेत्रों के अनुप्रयोग:
- रेडियो आवृत्ति क्षेत्र (106 Hz): प्रसारण के लिए उपयोग किया जाता है।
माइक्रोवेव क्षेत्र (1010 Hz): रडार के लिए उपयोग किया जाता है।
इन्फ्रारेड क्षेत्र (1013 Hz): गर्मी विकिरण।
पराबैंगनी क्षेत्र (1016 Hz): सूर्य के विकिरण का घटक।
दृश्य प्रकाश क्षेत्र (1015 Hz): मानव आंख के लिए दृश्य प्रकाश।
फोटोइलेक्ट्रिक प्रभाव:
- जब कुछ धातुएं जैसे कि पोटेशियम, रुबिडियम, और सीजियम उपयुक्त आवृत्ति की रोशनी के संपर्क में आती हैं, तो उनकी सतह से इलेक्ट्रॉन उत्सर्जित होते हैं। इस घटना को फोटोइलेक्ट्रिक प्रभाव के रूप में जाना जाता है।
प्लैंक का क्वांटम सिद्धांत
- 1900 में, प्लैंक ने विकिरण का एक क्रांतिकारी सिद्धांत प्रस्तुत किया जिसे क्वांटम सिद्धांत कहा जाता है। इस सिद्धांत के अनुसार, विकिरण ऊर्जा को छोटे पैकेटों में जो फोटॉनों (क्वांटा) कहलाते हैं, में निरंतरता के बिना उत्सर्जित या अवशोषित किया जाता है। विकिरण के एक क्वांटम से जुड़ी ऊर्जा की मात्रा विकिरण की आवृत्ति के समानुपाती होती है: E = hν (जहां E ऊर्जा है, ν आवृत्ति है, और h प्लैंक का स्थिरांक है)।
बोहर का मॉडल
ऊर्जा के क्वांटिज़ेशन के आधार पर, बोहर का मॉडल कई सिद्धांतों को शामिल करता है:
- इलेक्ट्रॉनों का नाभिक के चारों ओर निश्चित वृत्ताकार कक्षों में घूमना होता है, बिना ऊर्जा खोए या प्राप्त किए।
- इलेक्ट्रॉन केवल उन कक्षों में गति कर सकते हैं जहाँ उनका कोणीय संवेग h/2π का पूर्णांक गुणांक होता है (क्वांटाइज़ किया गया)।
- इलेक्ट्रॉनों की निश्चित ऊर्जा होती है जो उस कक्ष की विशेषता होती है जिसमें वे गति कर रहे हैं। जब तक इलेक्ट्रॉन एक कक्ष में रहता है, वह ऊर्जा नहीं खोता। n=1 में एक इलेक्ट्रॉन की संभवतः सबसे कम ऊर्जा होती है।
- ऊर्जा का अवशोषण या उत्सर्जन केवल इलेक्ट्रॉनों के निम्न और उच्च ऊर्जा स्तरों के बीच संक्रमण के माध्यम से होता है।
हाइजेनबर्ग का अनिश्चितता सिद्धांत
- इस सिद्धांत के अनुसार, "एक सूक्ष्म कण की स्थिति को एक साथ मापना और उसकी वेग या संवेग को निर्धारित करना असंभव है।"
- हाइजेनबर्ग का सिद्धांत मैक्रोस्कोपिक वस्तुओं (यानी, बड़े वस्तुओं) पर लागू नहीं होता है।
शेल और ऊर्जा स्तर
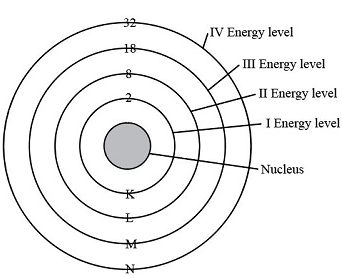
इलेक्ट्रॉनों में वे विशेष ऊर्जा होती है जो उनके द्वारा धारण किए गए कक्षों की विशेषता होती है, जिन्हें स्थिर कक्ष या शेल भी कहा जाता है। इन कक्षों को निम्नलिखित रूप में दर्शाया गया है:
- n = 1, 2, 3, 4
- शेल = K, L, M, N
n = 1 वाला शेल नाभिक के सबसे निकट होता है, और इस स्तर पर इलेक्ट्रॉन की ऊर्जा संभवतः सबसे कम होती है क्योंकि यह सकारात्मक चार्ज वाले नाभिक के निकट होता है।
परमाणु के विभिन्न कक्षों में इलेक्ट्रॉनों का वितरण
बोहर और बुरी द्वारा सुझाए गए वितरण नियम इस प्रकार हैं:
- एक शेल में अधिकतम इलेक्ट्रॉनों की संख्या का सूत्र है 2n2 (जहाँ n = 1, 2, 3 और 4 K, L, M, और N शेल के लिए क्रमशः है)।
- बाहरी कक्ष में अधिकतम 8 इलेक्ट्रॉनों को समायोजित किया जा सकता है।
- कक्षों को क्रमबद्ध तरीके से भरा जाता है।
इलेक्ट्रॉनिक कॉन्फ़िगरेशन
यह परमाणु में विभिन्न शेलों, उपशेलों, और कक्षों में इलेक्ट्रॉनों का वितरण है। इसे 2, 8, 8, 18, 18, 32 के रूप में या nlx (जहाँ n मुख्य क्वांटम संख्या है, l अज़ीमुथल क्वांटम संख्या या उपशेल है, और x इलेक्ट्रॉनों की संख्या है) के रूप में लिखा जा सकता है।
उदाहरण के लिए:
- n शेल में इलेक्ट्रॉनों की संख्या = 2n2
- दूसरे शेल में: इलेक्ट्रॉनों की संख्या = 2×22 = 8
परमाणुओं में कक्षों का भरण
कक्षों में इलेक्ट्रॉनों का भरण ऑफबॉ प्रिंसिपल, पौली का अपवाद सिद्धांत, और हंड का अधिकतम गुणन का नियम का पालन करता है:
- ऑफबॉ प्रिंसिपल: पहले सबसे कम ऊर्जा वाले कक्ष में इलेक्ट्रॉन प्रवेश करते हैं, उसके बाद क्रमशः बढ़ती ऊर्जा के क्रम में अन्य इलेक्ट्रॉन आते हैं।
- ऊर्जा क्रम: किसी कक्ष के लिए कम (n l) मान का मतलब है कम ऊर्जा। यदि दो कक्षों का (n l) मान समान है, तो कम n मान वाला कक्ष कम ऊर्जा वाला होता है।
- हंड का अधिकतम गुणन का नियम: समान ऊर्जा वाले कक्षों में इलेक्ट्रॉन जोड़ीकरण तब तक नहीं होता जब तक प्रत्येक कक्ष को समान स्पिन के साथ एकल रूप से नहीं भरा जाता।
ऊर्जा क्रम: किसी कक्ष के लिए कम (n l) मान का मतलब है कम ऊर्जा। यदि दो कक्षों का (n l) मान समान है, तो कम n मान वाला कक्ष कम ऊर्जा वाला होता है।
क्वांटम संख्याएँ
एक परमाणु में प्रत्येक इलेक्ट्रॉन को तीन क्वांटम संख्याओं के सेट द्वारा वर्णित किया जाता है, जिसमें इलेक्ट्रॉन के स्पिन को निर्दिष्ट करने के लिए चौथी संख्या की आवश्यकता होती है:
- प्रमुख क्वांटम संख्या (n): मुख्य ऊर्जा स्तर या शेल (K, L, M, N) को निर्धारित करती है। जैसे-जैसे n बढ़ता है, इलेक्ट्रॉन की ऊर्जा बढ़ती है।
- आज़िमुथल क्वांटम संख्या (l): एक दिए गए प्रमुख ऊर्जा स्तर में उपशेल (s, p, d, f) को निर्धारित करती है।
- मैग्नेटिक क्वांटम संख्या (m): ऑर्बिटल के उन्मुखीकरण के बारे में जानकारी प्रदान करती है।
- स्पिन क्वांटम संख्या (s): इलेक्ट्रॉन के स्पिन उन्मुखीकरण (घड़ी की दिशा में या घड़ी की दिशा के विपरीत) का वर्णन करती है।
यह सिद्धांत, जिसे वोल्फगैंग पाउली ने 1952 में प्रस्तुत किया था, यह कहता है कि एक परमाणु में कोई भी दो इलेक्ट्रॉन समान चार क्वांटम संख्याएं नहीं रख सकते।
रेडियोधर्मिता
रेडियोधर्मिता कुछ तत्वों की एक परमाणु विशेषता है, जहाँ भारी तत्व विकिरण उत्सर्जित करके हल्के तत्वों में विघटित होते हैं, जिसका पता हेनरी बेक्वेरल ने 1896 में लगाया था। विकिरण के प्रकारों में शामिल हैं:

- α-किरणें: डबल आयनित हीलियम आयनों से बनी होती हैं।
- β-किरणें: तेज गति वाले इलेक्ट्रॉनों से बनी होती हैं।
- γ-किरणें: विद्युत चुम्बकीय किरणों से बनी होती हैं।
रेडियोधर्मी उत्सर्जन:
α-भागिका उत्सर्जन: परमाणु संख्या को 2 से घटाता है और द्रव्यमान संख्या को 4 से घटाता है।
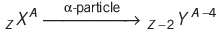
β-भागिका उत्सर्जन: परमाणु संख्या को 1 से बढ़ाता है और द्रव्यमान संख्या को अपरिवर्तित रखता है।

सॉडी फैजान का समूह विस्थापन नियम
यह नियम कहता है:
- α-भागिका का उत्सर्जन एक नए तत्व के निर्माण का परिणाम होता है जो मूल तत्व से आवर्ती तालिका में दो स्थान बाईं ओर होता है।
- β-भागिका का उत्सर्जन एक नए तत्व के निर्माण का परिणाम होता है जो मूल तत्व से आवर्ती तालिका में एक स्थान दाईं ओर होता है।
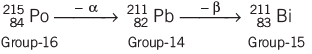
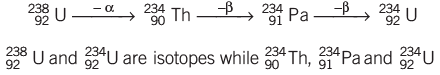
उत्सर्जन और आइसोटोप:
एक β-कण के उत्सर्जन से एक आइसोबार का निर्माण होता है। एक α-कण के उत्सर्जन के बाद दो β-कणों के उत्सर्जन से एक आइसोटोप का निर्माण होता है।
न्यूक्लियर आइसोमर्स और आइसोडियाफर्स:
- न्यूक्लियर आइसोमर्स: ऐसे परमाणु जिनकी परमाणु और द्रव्यमान संख्या समान होती है लेकिन उनकी रेडियोधर्मी विशेषताएँ भिन्न होती हैं (जैसे, विभिन्न आधे जीवन के साथ यूरेनियम)।
- आइसोडियाफर्स: ऐसे परमाणु जिनमें न्यूट्रॉन और प्रोटॉन के बीच का अंतर समान होता है या आइसोटोपिक संख्या समान होती है (जैसे, यूरेनियम-235 और थोरियम-231)।
रेडियोधर्मिता और रेडियोआइसोटोप्स के अनुप्रयोग:
- कार्बन डेटिंग: विलार्ड लिब्बी द्वारा विकसित, यह पुरातात्विक वस्तुओं की उम्र निर्धारित करने के लिए जीवित और मृत पौधों में C-14 के सांद्रता की तुलना करता है।
- भूगर्भीय डेटिंग: यह यूरेनियम की रेडियोधर्मी विशेषताओं का उपयोग करके चट्टानों की उम्र निर्धारित करता है, जिसमें यूरेनियम-239 और लीड-206 के अनुपात को मापा जाता है।
- ट्रेसर तकनीक: रेडियोधर्मी आइसोटोप्स को उनके पथ का अध्ययन करने के लिए जोड़ा जाता है, जिससे रेडियोधर्मिता को मापा जाता है; इसका उपयोग चिकित्सा निदान और प्रतिक्रिया तंत्र के अध्ययन में किया जाता है।
चिकित्सा उपचार:
- Co-60 कैंसर के ट्यूमर्स के इलाज के लिए।
- P-32 रक्त कैंसर (ल्यूकिमिया) के लिए।
- I-131 थायरॉइड विकारों के लिए।
- Na-24 रक्त संचार में दोषों का पता लगाने के लिए।
- Re-59 एनीमिया का पता लगाने के लिए।
- Se-79 अग्न्याशय ग्रंथि विकारों का पता लगाने के लिए।
- न्यूट्रॉन सक्रियण विश्लेषण: यह बिना नमूने को नष्ट किए तत्वों की सांद्रता को मापता है।
- कृषि: P-32 पौधों में फास्फोरस अवशोषण और खनिज लवण परिवहन का अध्ययन करता है।
न्यूक्लियर खतरे और सुरक्षा उपाय:
परमाणु विकिरण के भयंकर प्रभाव हो सकते हैं, जो शारीरिक प्रभाव (जैसे, कैंसर) और आनुवंशिक प्रभाव (जैसे, अगली पीढ़ी को पारित होने वाले हानिकारक आनुवंशिक उत्परिवर्तन) का कारण बन सकते हैं।
- परमाणु रिएक्टरों में, रेडियोधर्मी सामग्री लगातार उत्पन्न होती है, और खर्चीले ईंधन रॉड्स अत्यधिक रेडियोधर्मी हो जाते हैं।
- सुरक्षित भंडारण और देखभाल आवश्यक है ताकि लीक होने से रोका जा सके, जो जल निकायों और मिट्टी को प्रदूषित कर सकता है, जिससे मानव, पौधों और पशु जीवन को जोखिम हो सकता है।
|
464 docs|420 tests
|
















